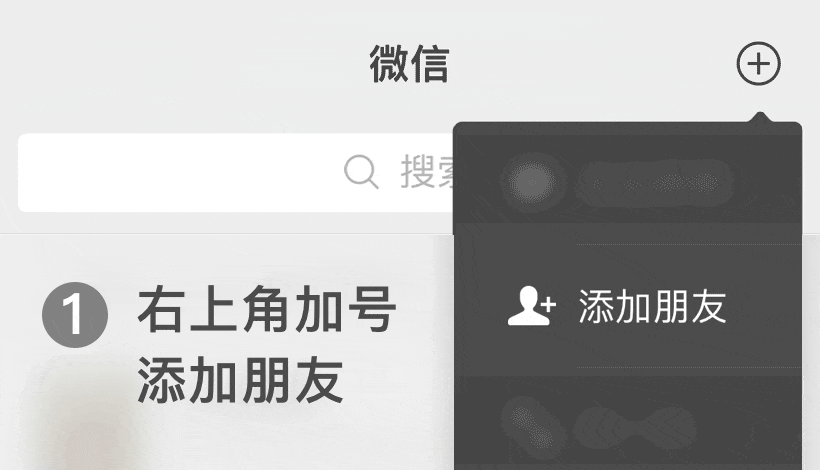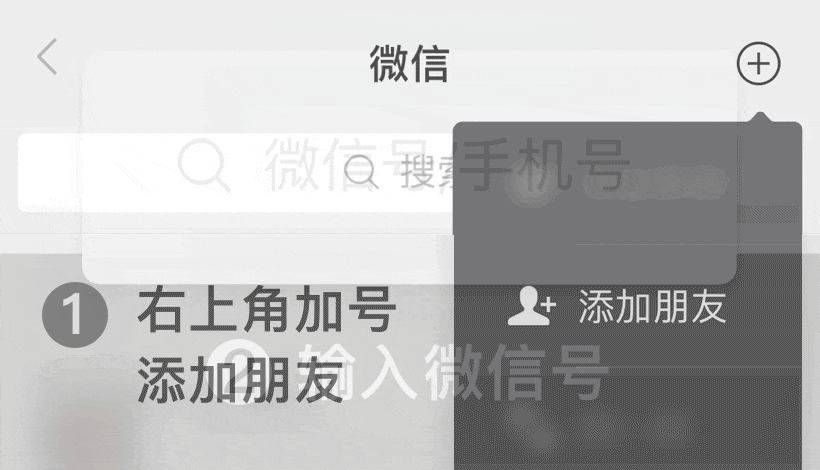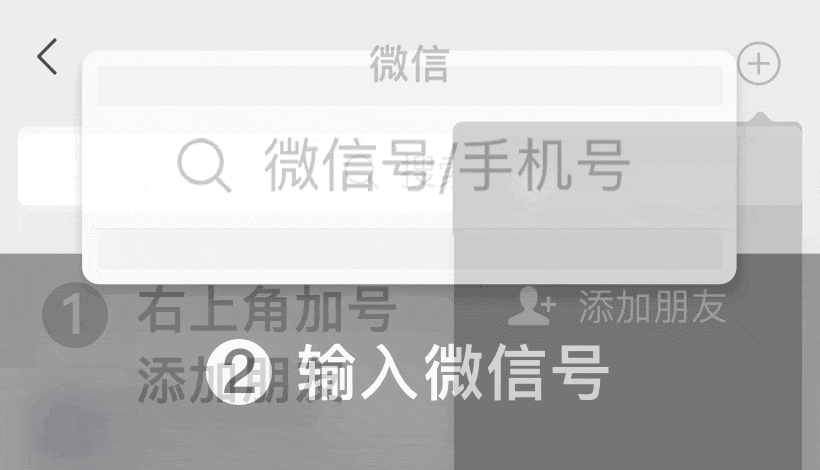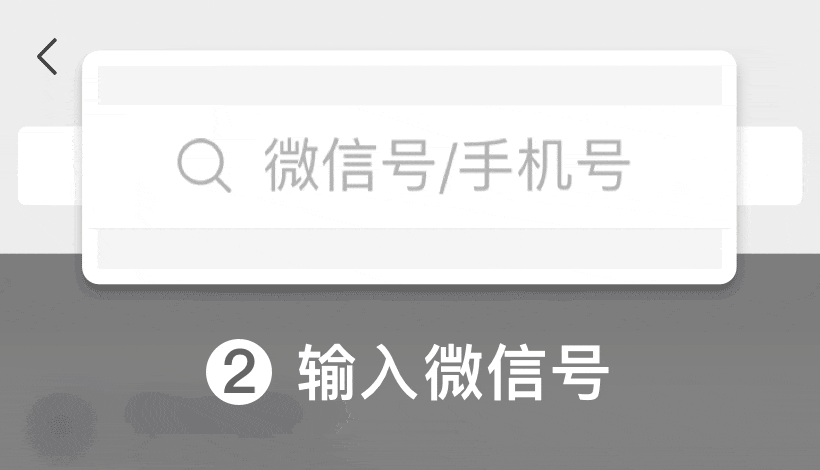
iso13485 2016医疗器械质量管理体系:根据ISO 13485:2016的基础设施要求
如何根据iso.com/' target='_blank' title='ISO' >ISO 13485:2016的要求管理质量手册

最新版本的ISO 9001将质量手册从文件要求中排除,而新的ISO 13485保留了对质量手册的要求,部分原因是它基于ISO 9001:2008。考虑到ISO 9001:2000和ISO 9001:2008之间的变化,反映在新的ISO 13485:2016(新版ISO 13485基于ISO 9001:2008,旧版基于ISO 9001:2000),质量手册的要求没有发生重大变化。尽管如此,这是一个很好的机会来更新你的手册,使它更好,更适合你的公司。
质量手册的要点
在大多数情况下,组织能够创建技术上符合ISO 13485要求的质量手册-但是,他们错过了拥有该文件的全部意义。结果,时间和精力被浪费在了一个没有人会读的大文件上——有时多达20、30,甚至50页——它不是质量管理体系(QMS)的基本文件,而是注定要被回收的纸张。
一本简明扼要的质量手册能给组织及其质量管理体系带来许多好处:
它为组织提供了一个展示其质量管理承诺和方法的媒介。
这是一个很好的地方来记录其他需求,除了条款4.2.2中要求的,在一个易于访问和易于阅读的格式。
它向利益相关者表明组织真正知道如何管理其产品和服务的质量。
它可以帮助审核员更好、更彻底地审核质量管理体系,从而能够提供改进系统的建议。
也许最重要的是,它为管理者代表以及过程所有者提供了质量管理体系的一个良好的俯视视图——谁更适合寻找需要改进的地方?
大公司和政府机构通常要求他们的供应商有质量管理体系,他们有时甚至要求查看他们正在考虑的供应商的质量手册。你是愿意向潜在客户展示一本精简的质量手册,表明你一切都掌握得很好,还是一本笨重的大部头书,表明你不介意浪费资源?
怎么做?
当创建或更新您的质量手册时,与标准的任何其他要求一样,您需要主要关注标准的实际要求,并在创造性之前尝试满足这些要求。当你采用这种方法时,编写一份的质量手册就不那么困难了;只要确保你包括4.2.2条款所要求的这些元素:
你们质量管理体系范围的定义
排除的列表(如果有的话)及其背后的原因
你的过程及其相互作用的描述,更好是图形形式,就像这个过程流程图
质量管理体系的文件化程序或对其的参考
这就是它的全部内容-您可以在本文中了解更多信息:ISO 13485:如何编写简短的质量手册。
手册还能包含什么?
考虑到质量手册是您的质量管理体系的镜像,您可能希望使其更吸引人或更全面,并添加一些您认为对您的质量管理体系或即将阅读它的人重要的其他信息。简而言之,我建议您(除了4.2.2条款的所有其他要求外)包括以下关于您组织的信息:
对公司的简要描述(甚至可能是简单的历史,以及发展中的主要里程碑)
贵公司的总体组织结构,说明各部门是如何组织的
你的使命和愿景
您的流程和它们之间的相互作用(流程图)
标准要求的排除,以及排除的理由
你想让人们看到什么?
当然,这有点过于简化了——你不可能把所有这些信息都放在一个简洁的项目符号列表中。但是,所描述的文件将满足新的条款4的要求,它可以作为一个有价值的营销工具,向潜在客户介绍你的公司。把它看作是一件积极的事情——你不必遵循严格的格式,也不必创建一堆你永远不会用到的文档。相反,您可以自由地使用一些创造力来确保从每个需求中获得更大收益。手册作者的最终目标是使它吸引人,易于阅读,这样人们就会真正使用它,而不是成为架子上最肥的除尘器。
根据ISO 13485:2016的基础设施要求
任何产品或服务的制造、设计或供应都需要基础设施——没有基础设施,任何公司都无法开展其活动。基础设施包括建筑、工作空间、公用设施、过程设备、仪器、信息技术系统和运输机制。同样,所有参与医疗器械制造或分销的公司都应保持健全的基础设施,以确保产品质量达到客户满意所需的水平。ISO 13485:2016要求组织管理确保产品符合性和质量的基础设施。
新修订的ISO 13485比以前的版本提供了更多的清晰度。ISO 13485:2016基础设施要求的重要目标包括防止产品混淆和确保有效处理产品订单。
根据ISO 13485对基础设施的要求
文档基础架构要求
识别可能影响质量的维护活动,并保持记录
提供控制工作环境所需的基础设施
提供监控和测量的基础设施
ISO 13485如何定义基础设施,在哪个条款中?

ISO 13485:2016将基础设施的目的确定为“实现产品要求的符合性”。该标准在要求6.3中将基础设施规定为:
建筑、工作空间和相关设施——这包括为产品制造和最终存储提供区域的建筑。工作空间是建筑内不同流程的独立区域,而相关的公用设施包括电力供应、燃气供应、供水、污水处理系统和互联网连接。因此,医疗器械公司必须维护一个基础设施,涵盖所有公用设施、建筑物(有效操作所必需的)、不同工艺所需的工作空间(例如,这些行业的工作空间有原材料仓库、铣削车间、热处理区、装配区、成品仓库等)。
工艺设备(硬件和软件)——这包括工艺设备硬件,即机械,和工艺设备软件,即运行这些机器的应用程序。例如,数控铣床是硬件,数控g代码编程是运行机器的软件。因此,医疗器械制造商必须维护足够的数控铣床,以满足生产计划(加工锻造部件的硬件)和g码程序(为所有项目代码保存的软件)。
支持服务(如运输、通信或信息系统)——所有用于运输、通信或信息系统的机制都被称为支持服务。医疗器械制造商必须维护传送带,叉车,货梯或任何其他运输机制,用于运输过程中,原材料或成品,这被称为运输服务。类似地,他们必须维护部门间通信所需的服务,如用于传递消息的内部文档、电子邮件系统或ERP系统。信息系统包括管理库存和生产过程信息的ERP系统。
根据ISO 13485对基础设施的要求
与ISO 13485:2003不同,最新标准中有一个新要求,要求组织维护基础设施以防止产品混淆,并确保以有序的方式处理产品。此外,在基础设施的支援服务分支下也增加了信息系统。
这些要求可以概括为:
记录基础设施需求——组织需要记录所有基础设施需求,以确保产品质量;避免在不同批次和其他产品(如不同类型或批次)内混合;并确保客户订单的有效处理。这可以通过一个有效的ERP系统来实现,该系统可以处理产品库存、客户订单、产品标签(带有可追溯编号、批号和产品代码)以及检查和生产状态。erp生成的生产卡与生产批次一起使用。在每个制造步骤中,生产操作员都会更新实物生产卡,并在ERP系统中更新状态,然后制造批次进入下一个制造操作。
识别可能影响质量的维护活动,并保持记录——在计划的时间间隔内,所有影响产品质量的加工设备(无论是硬件还是软件)的维护活动都应被识别、记录和管理。例如,组织分析不良质量记录、返工和拒收。分析结果表明,数控铣床的不良率为80%。这是由于锻造工件在数控铣床上的坐位不当,切削屑卡在工件与机床塞面之间造成的。因此,您可以为每台CNC机器制定可视化的自主维护计划,要求操作员每天清洁工件塞子表面和CNC机器的其他部件。
提供控制工作环境所需的基础设施——确保最终产品的质量需要一个受控的工作环境。因此,应确定并提供用于监测和维护环境的设备(空调、加热器、温湿度计或任何其他设备)。
提供监控和测量的基础设施-所有用于监控和测量产品质量的设备都应该被识别和提供(游标卡尺,千分尺,量规),并在检查点提供(例如,在数控铣床上设置对加工零件的检查)。必须通过外部和内部校准来确保这些设备的有效性。
ISO 13485基础设施要求的好处和目标
ISO 13485基础设施要求的好处包括:
加强质量管理:实施ISO 13485基础设施要求有助于组织建立健全的质量管理体系。这使他们能够始终如一地提供安全有效的医疗设备,并满足监管要求。
提高效率:通过定义良好的基础设施需求,组织可以简化他们的过程,减少错误,并提高他们的操作效率。这可以节省成本并提高生产率。
风险管理:ISO 13485基础设施要求强调了医疗器械行业风险管理的重要性。通过实现这些需求,组织可以识别并减轻与基础设施相关的风险,确保其产品的安全性和可靠性。
ISO 13485基础设施要求的目标是:
建立足够的设施:基础设施要求旨在确保组织拥有适当的设施来支持医疗器械的设计、开发、生产和分销。这包括适当的工作空间、公用设施和环境条件。
确保适当的设备:ISO 13485要求组织拥有必要的设备,包括硬件和软件,以支持其运营。这确保了过程和产品结果的准确性、可靠性和一致性。
有能力的人员:基础设施要求强调需要有能力的人员,他们能够有效地执行分配给他们的任务。这包括拥有经过适当培训、技能和知识的合格员工,以确保医疗器械的质量和安全。
实施ISO 13485基础设施要求有助于组织为其质量管理体系建立坚实的基础,提高产品质量,并满足医疗器械行业的法规要求。
帮助组织理解对基础设施的需求
如果没有ISO 13485标准,组织可能无法全面满足基础设施要求。这意味着组织可能会在基础设施的重要部分上妥协,从而导致许多类型的问题,这些问题必须在问题发生后进行处理。例如,如果对工艺设备(如熔炉,皮带磨床,数控机床)的维护活动,其缺勤影响产品质量,没有正确识别,也没有按规定的时间间隔进行,将会发生什么?工艺设备开始出现故障,生产出次品。反应性方法将是返工,然后是故障维护。这种方法浪费了时间、金钱、工具、劳动时间等等。
ISO 13485标准,凭借其有效的组织基础设施,使组织更容易主动处理潜在的不合格品和缺陷批次。在健壮的基础设施的帮助下,组织可以有效地管理其操作,确保产品质量,避免过程损失,并获得客户满意度。ISO 13485:2016帮助组织建立这样一个具有强大基础设施的系统,确保业务卓越。
ISO 13485:2016中对医疗器械文件的要求是ISO技术委员会(TC 210)的一项努力,旨在为医疗器械制造商创建一致的操作,并使其质量管理体系符合各种监管机构的规则。
医疗设备的制造商和供应商必须管理数百种甚至数千种不同的医疗产品。因此,这些组织将其设计和开发过程、制造流程、设备记录以及每个设备系列的先进制造控制记录下来是至关重要的。这使公司能够在需要时一次又一次地重现流程,并避免在制造或交付医疗器械期间出现任何空白或不符合项。这就是为什么ISO TC 210包含医疗器械文件的要求。
医疗器械文件在以前的标准版本ISO 13485:2003中没有强制要求,尽管它是几个的监管要求-例如,美国的FDA 21 CFR Section 820和欧洲的医疗器械指令93/42/EEC。随着ISO 13485:2016中关于医疗器械文件的子条款4.2.3的增加,该标准为实施组织带来了更高的价值。
医疗器械文件要求
医疗设备文件是包括设计记录、制造过程、产品规格、设备使用指南、质量测量标准、符合监管机构和质量标准的水平的描述的文档,如果需要,还包括维修和安装记录及其指南。组织应该为每个产品类型或设备系列开发和维护医疗器械文件。ISO 13485:2016子条款4.2.3规定了医疗器械文件中应包含的各种要素的要求。这些要素包括:
1)建立和维护每个器械系列的文件——了解医疗器械系列是至关重要的;例如,我们有凯利钳,它可以被认为是一个医疗器械家族。然而,在这个家族中,有各种类型的镊子,可以在尺寸、夹紧规格、手柄规格、材料规格或其他设计规格上有所不同。但是,设计规范的基础可以归为一类。因此,对于被认为是一个家族的每一组设备,必须有一个医疗设备文件。
2)保持证明符合性的参考文件-对于每个医疗器械文件,组织应保持其符合ISO 13485和适用法规要求的证书的参考。这意味着医疗器械文件应该包含符合性证书,或者它应该引用任何证明开发、制造、包装、存储和处理中的所有过程符合ISO 13485要求和适用法规要求的文件。参考资料可以是基于ISO 13485和相关法规要求的质量手册。
3)包含每个产品系列的描述-每个产品系列的医疗器械文件应包含医疗器械的一般描述,以及其预期用途或目的。它还应包含ifu的主记录,即使用说明。说明还应包括对标签的要求,例如零件代码、设备名称、条形码或CE要求。
4)制定和维护每个医疗器械系列的程序-每个医疗器械文件必须包含已开发的程序,或指定生产和所有相关制造过程的程序,即包装,库存保存,安全移动和包装医疗产品的运输。每个医疗器械家族的所有生产工艺流程,包括检查点,都需要清楚地记录下来。
5)制定和维护产品测量的规范和程序——医疗器械文件应包含或参考每个SKU(库存单元)的所有规范文件(例如,器械关键尺寸、材料规范、制造规范和精加工规范)。它还应规定该系列设备的检查程序,工艺中的检查点,产品的关键参数,以及将用于检查关键参数的仪器。
6)维修和安装的文件程序-此要求仅适用于需要维修或安装的设备或服务,例如心电图仪,x光机等。医疗器械文件应在适用的情况下保存器械安装的文件化信息,并应规定维修程序。设备安装的文件化信息可能包含安装步骤或安装记录。维修程序可以包括例行维护的频率,以及预防性维护和维修的工艺流程。
医疗设备制造、交付和使用的基础

医疗器械文件的概念和要求是医疗器械制造过程、交付和使用的基础,因为它们详细说明了医疗产品生命周期的所有制造和功能方面。在医疗器械文件的要求出现之前,组织必须为产品生命周期的每个方面遵守不同的文件集,或者他们必须组织类似于医疗器械文件的东西;否则,他们将面临制造工艺流程的严重差距。
医疗器械文件可更大限度地缩短生产时间,防止重复流程,并更大限度地减少由于制造模型不清楚或含糊不清而导致的制造和交付过程中的运输损坏。组织可以通过清晰、文档化的程序有效地管理其制造和运输过程,这些程序在每个产品设备系列的医疗设备文件中都是集中和控制的。